近日,Plant Biotechnology Journal杂志在线发表了我校生命科学学院张辉教授团队的最新研究成果“Efficient creation of decorative double-flowered petunia through CRISPR/Cas9-mediated simultaneous editing of PMADS3 and FBP6 genes”。该研究针对传统育种中重瓣花品种较难获得的瓶颈问题,利用高效的多位点CRISPR/Cas9基因编辑技术,实现对矮牵牛中两个调控雄蕊和心皮发育的C类基因PMADS3与FBP6的同时精准敲除,成功创制出层次丰富、性状稳定的“花中花”型重瓣矮牵牛,具有极高的观赏性和广阔的应用潜力。本研究不仅为重瓣花卉的精准生物育种提供了可行方案,也为提升我国花卉种质创新能力提供了新思路。

重瓣花因其更强的观赏性和稀缺性,在花卉植物中被视为最具吸引力的性状之一。大多数重瓣花是由于雄蕊瓣化以及心皮转化为额外花器官所形成的。根据经典的ABC花器官发育模型,C类AGAMOUS(AG)基因控制雄蕊与心皮的发育及花决定性(floral determinacy)(Bowman et al.,1989; Schwarz-Sommer et al., 1990)。当C类基因发生突变时,通常会导致同源异型转化(即一个器官发育为另一个器官),如雄蕊转化为花瓣,心皮转化为类似花瓣的新器官,从而形成重瓣花。长期以来,研究者尝试利用自然变异或诱变方式获得AG类基因的功能缺失突变体,以创制重瓣花品种。然而,由于大多数植物通常携带两个功能冗余的AG类同源基因,使得通过自然或诱变手段获得完全敲除型突变体十分困难(Kramer et al., 2004)。此外,由于重瓣花中雄蕊和心皮发育异常,难以通过杂交手段将该性状转移到其他品种。
现代生物技术为利用AG类基因创制重瓣品种提供了新机遇(Zhang et al., 2020)。例如,研究人员通过嵌合抑制子基因沉默技术(Chimeric repressor gene-silencing technology, CRES-T),有效降低了仙客来(Cyclamen persicum)中AG类基因CpAG1和CpAG2的表达,成功获得重瓣仙客来(Tanaka et al., 2013)。近年来,利用CRISPR/Cas9基因编辑技术,研究者在夏堇(Torenia fournieri)中敲除两个AG类基因TfFAR和TfPLE,使得雄蕊转变为花瓣,心皮转变为花瓣状器官;而在龙胆(G. scabra × G. triflora)中敲除AG1类基因,则仅使雄蕊转变成花瓣,心皮发育未受显著影响(Sasaki and Ohtsubo, 2020;Nishihara et al., 2023)。
矮牵牛作为园林应用广泛的花坛植物,素有“草花皇后”之称,但其重瓣品种极为稀少。该物种中含有两个AG同源基因——PETUNIA MADS BOX GENE3(PMADS3)和FLORAL BINDING PROTEIN6(FBP6),二者在雄蕊、心皮发育及花决定性调控中具有功能冗余性(Angenent et al., 1993;Tsuchimoto et al., 1993)。已有研究尝试通过RNA干扰(RNAi)技术同时下调这两个基因的表达,诱导雄蕊瓣化和心皮重构为额外花器官,从而形成重瓣花表型(Heijmans et al., 2012;Noor et al., 2014)。然而,RNAi方法在植物中常面临靶基因沉默效率低、性状遗传不稳定等问题,难以实现可用于育种的稳定材料创制(Chaudhary et al., 2024)。
针对上述问题,上海师范大学张辉教授团队利用CRISPR/Cas9技术,在实验室常用品种W115(Mitchell)与商业品种Mirage Rose中同时敲除了PMADS3和FBP6基因,成功获得了一系列不同程度的重瓣矮牵牛,该研究为在不同花卉植物中创制重瓣品种提供了可行的技术策略。
全文主要研究结果如下:
构建eDGE1载体并实现对PMADS3与FBP6基因的靶向编辑
在常用的双子叶基因编辑载体(由AtU6启动子驱动sgRNA表达,35S启动子驱动Cas9表达)的基础上,研究者引入了已知可显著提升遗传转化再生效率的葡萄来源的GRF4-GIF1嵌合元件(Debernardi et al., 2020)。此外,在GRF4的miR396结合序列引入6个同义突变用于进一步提高效率,从而构成出增强型双子叶基因编辑载体eDGE1 (enhanced dicot genome editing 1)(图1A)。为实现对PMADS3与FBP6基因的靶向编辑,研究者在这两个基因的第一外显子区域设计了特异性gRNA序列(图1B),并利用已被证实在矮牵牛中表现良好的tRNA多靶点表达系统(Xie et al., 2015; Sun et al., 2018),将两个靶序列同时克隆至eDGE1载体中。
该编辑载体随后用于转化实验室常用的矮牵牛二倍体品种W115(Mitchell)。在获得的16棵转化株系中,FBP6的编辑效率达100%,其中纯合或双等位突变率为43.75%,杂合/嵌合突变率为56.25%;PMADS3的编辑效率为37.50%(图1C)。研究者选择了#4与#12两个代表性突变株系进行后续分析:其中,#4株系中PMADS3为WT/+1bp杂合突变,FBP6为-1bp/-4bp双等位突变;#12株系中PMADS3为WT/+1bp杂合突变,FBP6为-1bp的纯合突变(图1D)。表型观察显示,这两个株系的花药均发生了明显的瓣化转化,并伴随柱头结构异常:#4株系的柱头呈现线状分裂形态,#12株系的柱头则体积显著增大,并发生明显裂开(图1E)。以上结果表明,尽管PMADS3仍处于杂合状态,FBP6的单基因突变已可显著诱导雄蕊瓣化并导致弱重瓣花表型的形成。
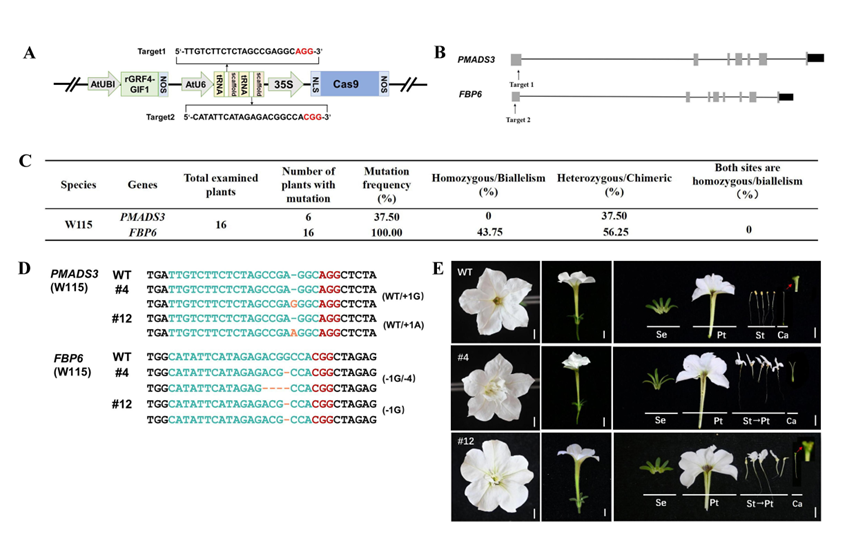
靶向编辑PMADS3与FBP6基因在矮牵牛W115中形成弱重瓣花表型
在商业化矮牵牛中同时靶向编辑PMADS3与FBP6创制丰富的重瓣花
为验证该基因编辑策略在不同品种中的通用性,研究者进一步在商业矮牵牛品种 Mirage Rose 中同时敲除了 PMADS3 和 FBP6 两个基因。经反转录测序分析发现,Mirage Rose 与W115品种在PMADS3和FBP6的编码序列完全一致,因此可直接采用前述构建的编辑载体进行遗传转化(图1A)。
共获得 120 株 Mirage Rose 再生植株。基因型检测显示,PMADS3 的编辑效率为 55.83%,其中 10.00% 为纯合或双等位突变体;FBP6 的编辑效率为 85.00%,其中 74.17% 为纯合或双等位突变体。两个基因同时发生纯合/双等位突变的效率为 3.33%(图2A)。
研究者从中筛选出株系 #40、#46 和 #105 进行进一步分析。#40 中 PMADS3 基因为 WT/+1 bp 杂合突变,FBP6 为 −2 bp 纯合突变;#46 的 PMADS3 为 +1 bp 纯合突变,FBP6 为 −6 bp 纯合突变,该突变导致 MADS box 保守结构域中缺失两个氨基酸;#105 的两个基因均为双等位突变,PMADS3 为 +1 bp/−1 bp,FBP6 为 −1 bp/−3 bp(图2B)。表型观察显示,这三株材料在整体植株形态上与野生型无显著差异,但均表现出稳定的重瓣花表型(图2C)。三者均出现明显的雄蕊瓣化现象,但瓣化雄蕊形成的花瓣大小存在显著差异(图2E):其中 #105 的瓣化花瓣最大,#40 最小。三株系均表现出心皮转化成新花器官,但转化程度有所不同:#40 的心皮转化为未充分发育的花器官,#46 和 #105 的心皮则转化成明显的新花器官(图2E)。其中, #105花中央形成了一个大的新花器官,呈现出 “花中花”形态,该重瓣花层次丰富、结构精美,具有极强的观赏性(图2E)。
不同株系之间重瓣程度的差异,与各自中两个基因的突变情况密切相关:#105 的 PMADS3 与 FBP6 均为双等位突变,导致C类基因功能的完全丧失,产生最为显著的“花中花”型重瓣表型;#40 中 PMADS3 为杂合突变,FBP6 为纯合突变,因此重瓣程度较弱;#46 中虽然两个基因均为纯合突变,但 FBP6 的 −6 bp 缺失仅导致两个氨基酸缺失,可能保留部分残余功能,重瓣性状介于两者之间。这些结果进一步支持 PMADS3 和 FBP6 在调控雄蕊和心皮发育及花决定性方面具有高度的功能冗余性。
为进一步验证突变材料中靶基因的表达变化,研究者对株系 #40、#46 和 #105 进行了 qRT-PCR 分析(图2D)。与野生型相比,PMADS3 的表达量在 #40、#46 和 #105 中分别下降了约 79.14%、97.66% 和 98.02%;FBP6 的表达量分别下降了 97.00%、96.55% 和 89.51%,进一步证实了编辑效率和功能缺失效果。
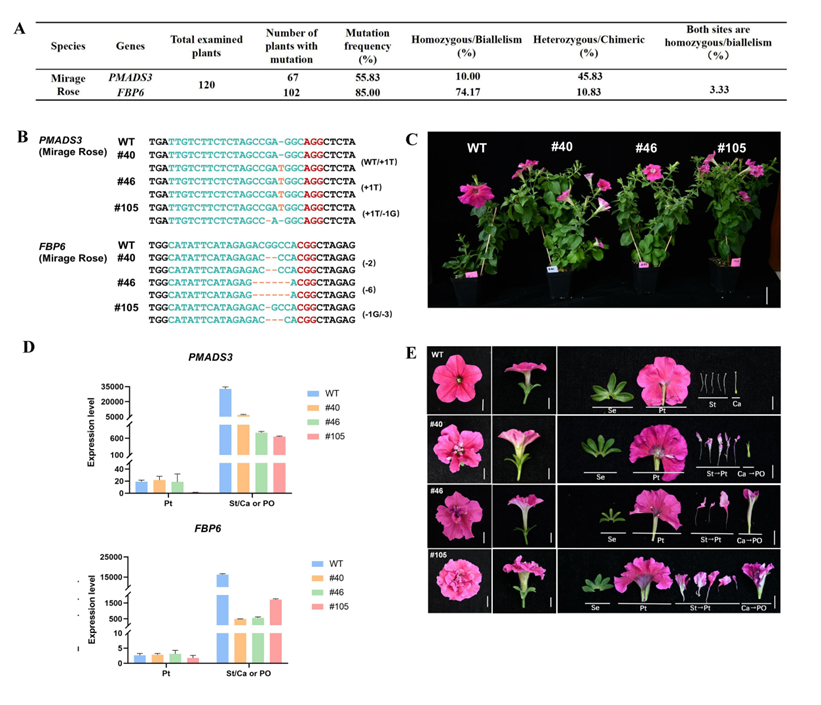
在Mirage Rose中同时靶向编辑PMADS3与FBP6创制丰富的重瓣花
重瓣性状可通过扦插实现稳定遗传
为验证基因编辑所获得的重瓣表型在无性繁殖过程中的遗传稳定性,研究者对株系 #40、#46 和 #105 进行了扦插繁殖实验。结果显示,所有扦插后获得的植株均完整保留了母体的重瓣花特征,未观察到性状分离或退化现象。
该结果表明,通过CRISPR/Cas9 编辑获得的重瓣性状可在矮牵牛中通过营养繁殖方式实现稳定传递,具备良好的应用推广前景。

基因编辑重瓣矮牵牛通过扦插繁殖保持性状稳定性
花器官决定基因调控矮牵牛重瓣性状的分子机制解析
为解析花器官决定基因在矮牵牛重瓣性状形成中的分子机制,研究者对典型重瓣材料 #105 株系及其野生型对照的花瓣、雄蕊/心皮(或瓣状器官)进行了RNA测序(RNA-seq)分析。
结果显示,在野生型植株中,FBP6 和 PMADS3 基因在雄蕊/心皮组织中高表达,而在花瓣中几乎不表达;相比之下,在 #105 株系的瓣状器官中,这两基因的表达水平显著下降,分别为野生型的 6.43%(FBP6) 和 3.83%(PMADS3),与前述 qRT-PCR 分析结果一致(图2D,图4)。A类基因(FBP29、AP2 和 FBP26)在野生型花瓣中表达活跃,其中AP2表达量最高,但在雄蕊和心皮中的表达极低或几乎不可检测。在#105中,A类基因在花瓣中的表达水平与野生型相近,而在瓣状器官中均表现出显著上调,提示其参与瓣化结构的形成(图4)。对于B类基因(TM6、GLO1、GLO2 和 DEF),除 TM6 外,其余基因(DEF、GLO1 和 GLO2)在野生型中于花瓣及雄蕊/心皮中均有表达,花瓣中表达水平略高。而在#105中,它们在瓣状器官中的表达显著升高,接近或达到花瓣水平,支持其在雄蕊瓣化过程中的作用(图4)。值得注意的是,TM6 在野生型中主要在雄蕊/心皮中表达,在花瓣中表达较弱,而在#105中其在瓣状器官中的表达显著下降,接近花瓣表达水平,进一步支持其表达变化与器官命运转化相关。
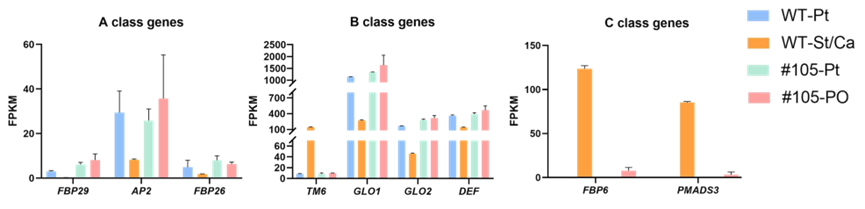
野生型与基因编辑重瓣矮牵牛中 ABC 类花器官发育基因的转录表达分析
进一步通过加权基因共表达网络分析(Weighted correlation network analysis,WGCNA),研究者发现 FBP6 与 PMADS3 具有最高的共表达相关性,表明它们在花器官发育中的紧密协同作用。此外,WGCNA还鉴定出多个与PMADS3和FBP6高度共表达的 MADS-box 家族转录因子成员,包括B类基因 TM6,以及此前未在重瓣调控中报道的 AGL19 和 MADS9,提示它们可能参与调控花决定性及瓣化过程,为后续创制重瓣花品种提供了新的潜在分子靶点。本研究展示了利用基因编辑技术在花卉重要性状改良中的巨大应用潜力,未来有望将该策略拓展至其他观赏植物,实现更多高品质花卉的定向创制与个性化设计育种,助力我国花卉产业从“产量型”向“品质型”与“创意型”转型升级。
上海师范大学硕士生薛迎双、副教授汪冲和硕士生葛容为论文共同第一作者,张辉教授为通讯作者。本研究得到了上海市农业科技创新计划及崇明区农业科技创新项目的资助。
论文链接:https://onlinelibrary.wiley.com/doi/10.1111/pbi.70236
(供稿、图片:生命科学学院)












 徐汇校区:上海市徐汇区桂林路100号
徐汇校区:上海市徐汇区桂林路100号