近日,我校赵宝国教授和肖晓教授团队首次实现了苏氨酸醛缩酶催化的甘氨酸aldol反应的仿生不对称催化模拟,攻克了这一困扰领域四十年的催化难题。开发的仿生aldol反应兼具高效性与普适性,为手性β-羟基-α-氨基酸的合成提供了迄今最简洁、高效的通用策略。运用高通量平行合成策略,通过该反应可快速构建结构多样的手性β-羟基-α-氨基酸酯活性分子库,为药物发现提供重要分子资源,展现了其在生物活性分子的精准构筑和不对称高通量合成方面的强大能力。相关成果以“Asymmetric Biomimetic Aldol Reaction of Glycinate Enables Highly Efficient Synthesis of Chiral β-Hydroxy-α-Amino Acid Derivatives”为题发表在《Nature Catalysis》上。上海师范大学为第一署名单位,20级博士生梁撼宇为论文第一作者,赵宝国教授和肖晓教授为论文共同通讯作者。

酶促转化产物常具高生物活性,如苏氨酸醛缩酶催化甘氨酸与醛的aldol反应,生成的手性β-羟基-α-氨基酸是多种药物关键结构单元。受限于酶底物特异性及化学合成瓶颈,手性β-羟基-α-氨基酸的高效构建长期是合成难题。酶促甘氨酸aldol反应的仿生催化研究,有望为手性β-羟基-α-氨基酸的高效合成带来突破。然而,该研究历经四十余年仍停滞于计量模拟,不对称催化模拟仍是一个亟待解决的科学难题。苏氨酸醛缩酶催化合成手性β-羟基-α-氨基酸面临底物范围受限和β-碳立体选择性不足的双重瓶颈(图1b)。该生物过程的仿生模拟始终未能突破计量模拟的局限(图1c)。仿生aldol反应为手性β-羟基-α-氨基酸的高效合成提供了新思路,但面临多重挑战:反应的可逆性导致产物易发生分解;产物在吡哆醛催化条件下倾向于发生差向异构化;醛与甘氨酸形成的亚胺会显著抑制aldol反应(图1d)。
我校赵宝国教授团队一直以来致力于仿生不对称催化,他们发展了基于维生素B6的羰基催化的有机催化新模式(Science. 2018, 360, 1438;Acc. Chem. Res. 2023, 56, 1097–1117)。在数年的研究攻坚后,团队终获突破,发展了方酰胺侧链修饰的手性吡哆醛催化剂,整合了多重活化、协同催化和底物识别等生物催化特征,成功实现了苏氨酸缩醛酶催化的这个重要生物反应的仿生模拟,并验证了仿生策略的合成应用性和通用性(图1e)。
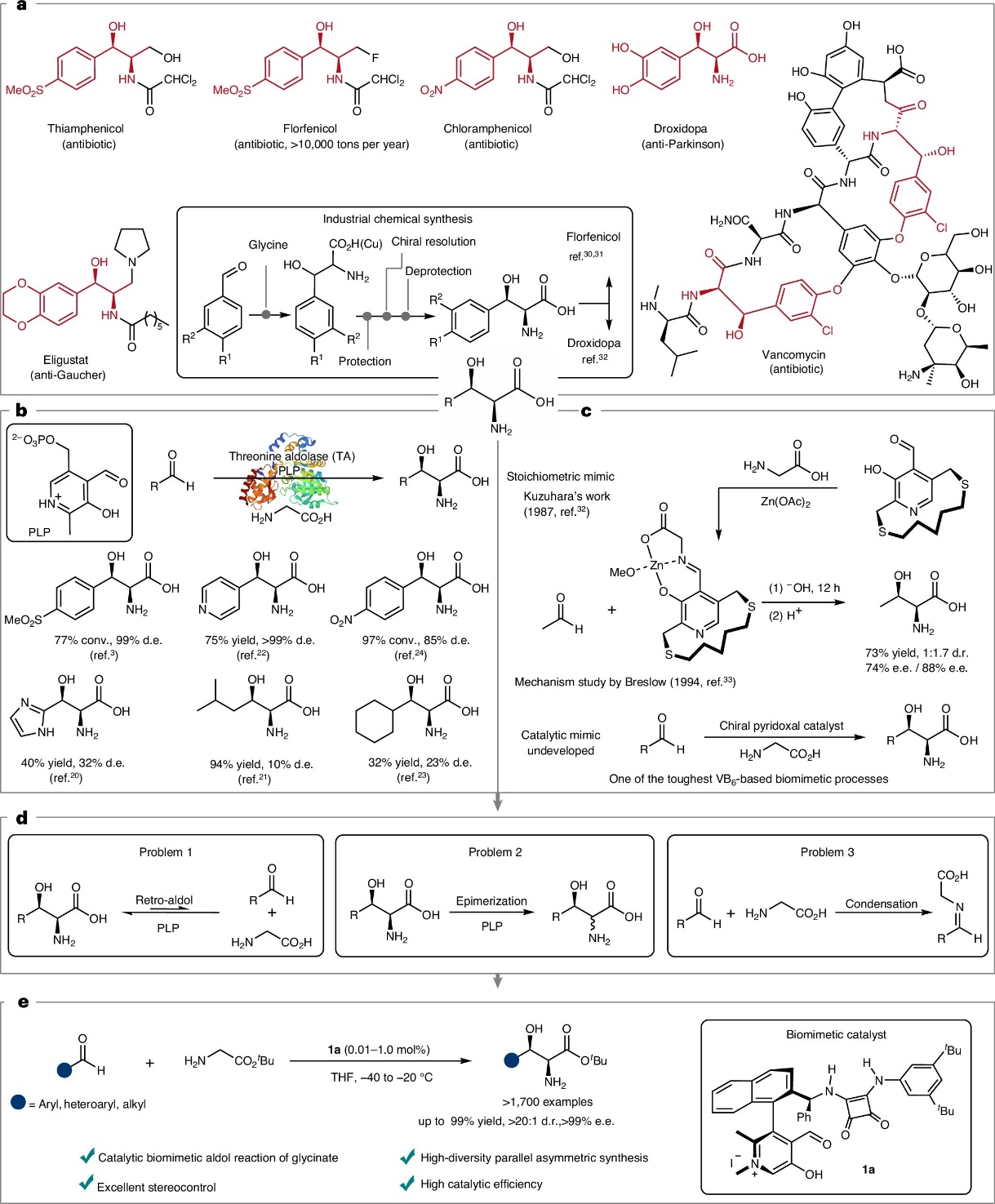
图1.手性β-羟基-α-氨基酸及其合成方法
主要研究成果
该转化具有优秀的底物适应性:取代芳基醛、杂芳醛和烷基醛均能顺利反应,以高产率、优秀立体选择性(up to >20:1 dr和 >99% ee)生成一系列手性β-羟基-α-氨基酸酯。醛的电子性质对反应影响较小,富电子与缺电子底物均具较高活性。该反应具有重要的应用价值:抗生素类药物(甲砜霉素、氟苯尼考、氯霉素、万古霉素)、代谢调节药物(伊利格鲁司te)、天然产物(乳胞素、二氢鞘氨醇)以及多种生物活性分子(4h、4af、4at等)的关键结构均可通过该反应高效合成(图2)。
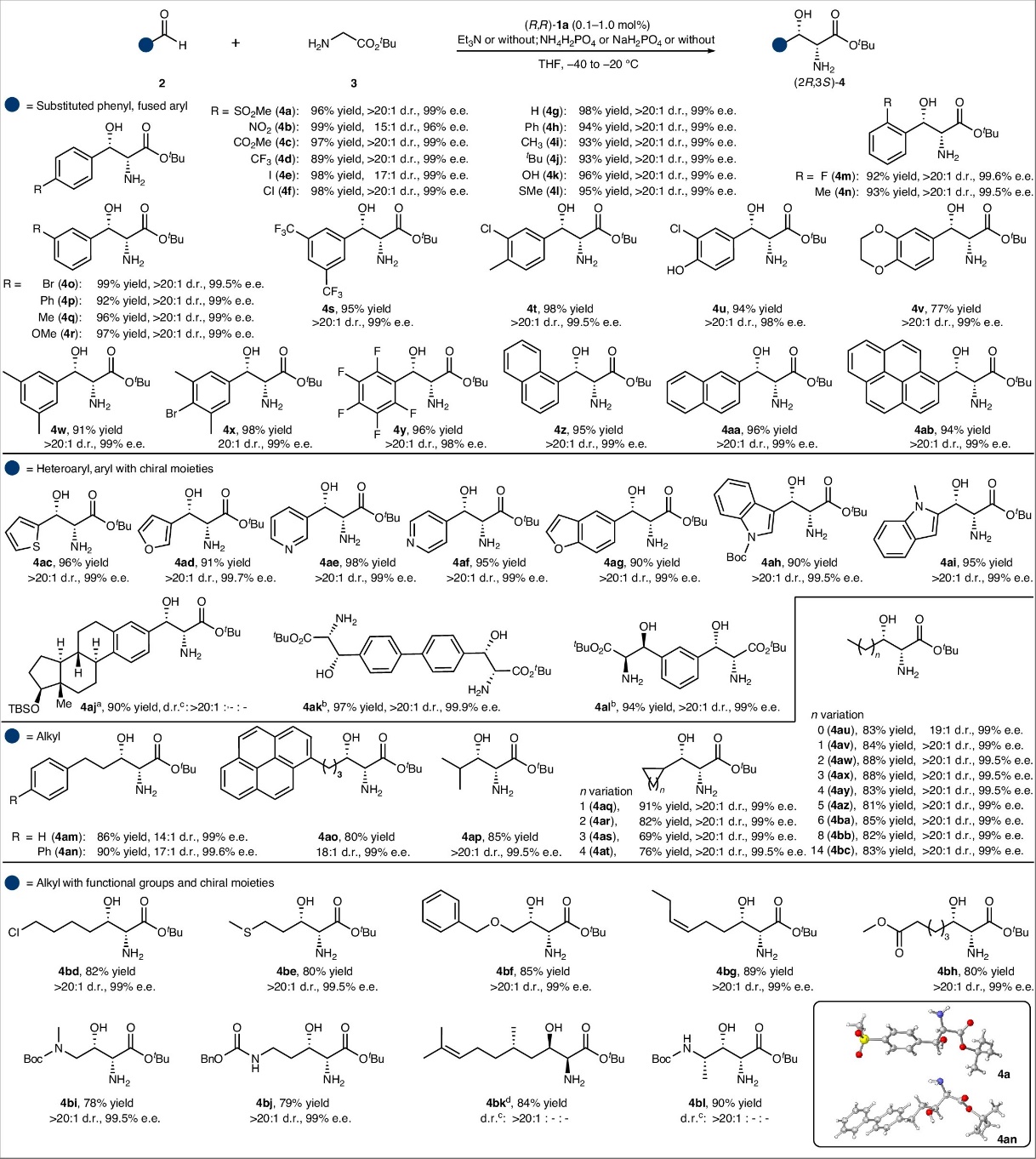
图2. 甘氨酸酯与醛的不对称aldol反应的底物拓展情况
该反应可用于多种药物的快速构建:在0.01 mol%的催化剂用量下,一步立体选择性构建氟苯尼考关键中间体L-苏-对甲磺酰苯丙氨酸酯(82% yield、15:1 dr和98% ee)(图3a);药物分子屈昔多巴也可以通过仿生aldol反应两步快速合成(图3b)。同传统合成方法相比,仿生合成路线无需手性拆分,避免了复杂的保护基操作,显著缩短了合成步骤,具备明显的成本和环境优势。手性β-羟基-α-氨基酸酯产物具有重要的合成价值,可作为多功能合成子灵活转化为各类关键手性化合物(图3c)。此外,以手性醛2bl为起始原料,该反应还能实现立体发散性合成,高效制备四种非对映异构体(图3d)。
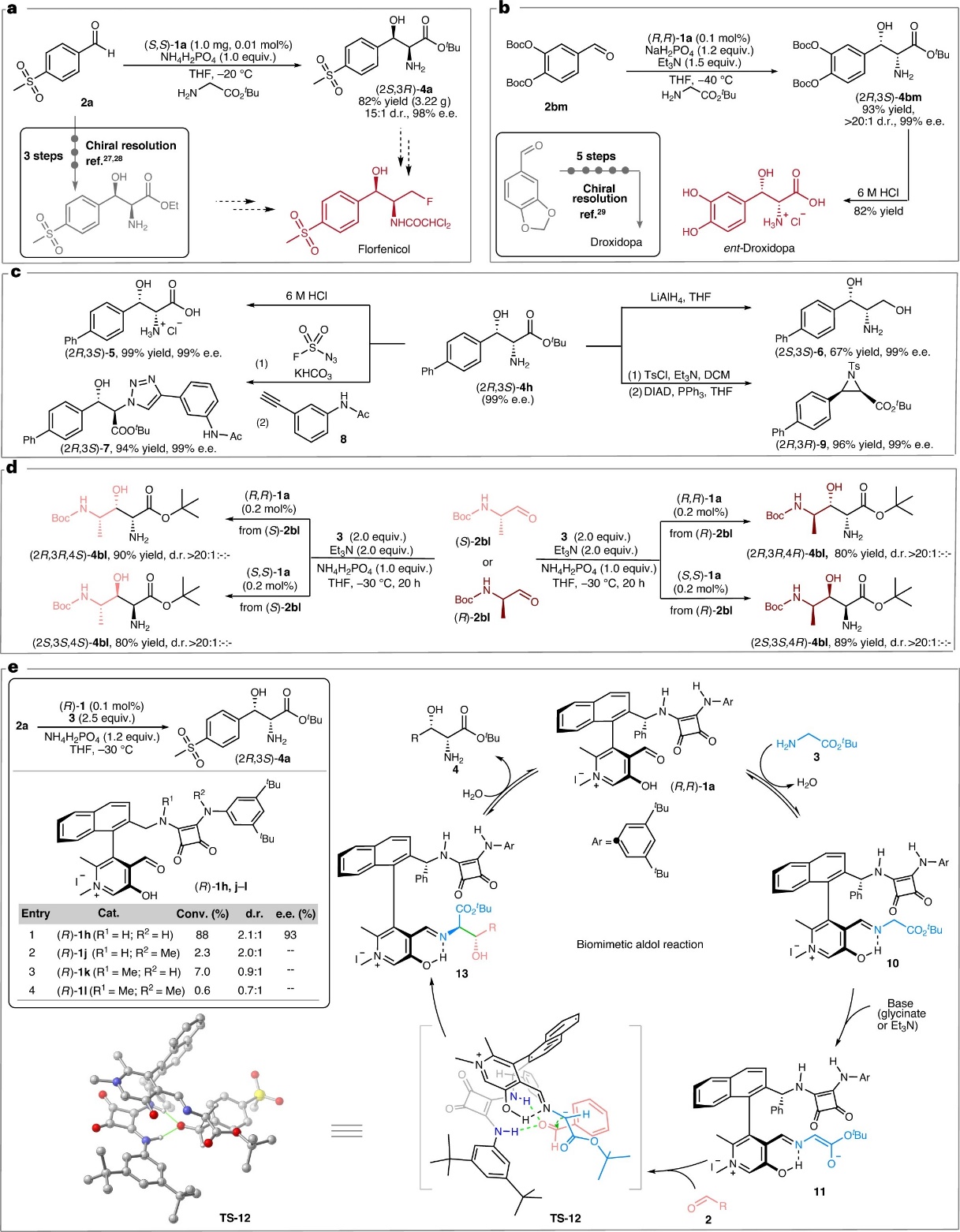
图3.合成应用及产物衍生化
该反应具有罕见的高效性和广谱性,运用高通量合成策略,可以快速构建数以万计的手性β-羟基-α-氨基酸酯。为了展示该反应在构建分子结构多样性方面的强大能力,作者通过高通量手性合成技术,成功构建了一个包含1700多种手性β-羟基-α-氨基酸酯的高活性化合物库,为后续的药物筛选提供了物质基础。尽管底物结构高度多样,大多数反应仍具有优秀的转化率和立体选择性。反应无需分离纯化,经简单后处理即可得到较高纯度的目标产物,特别适用于以快速筛选为目的的生物活性研究(图4)。
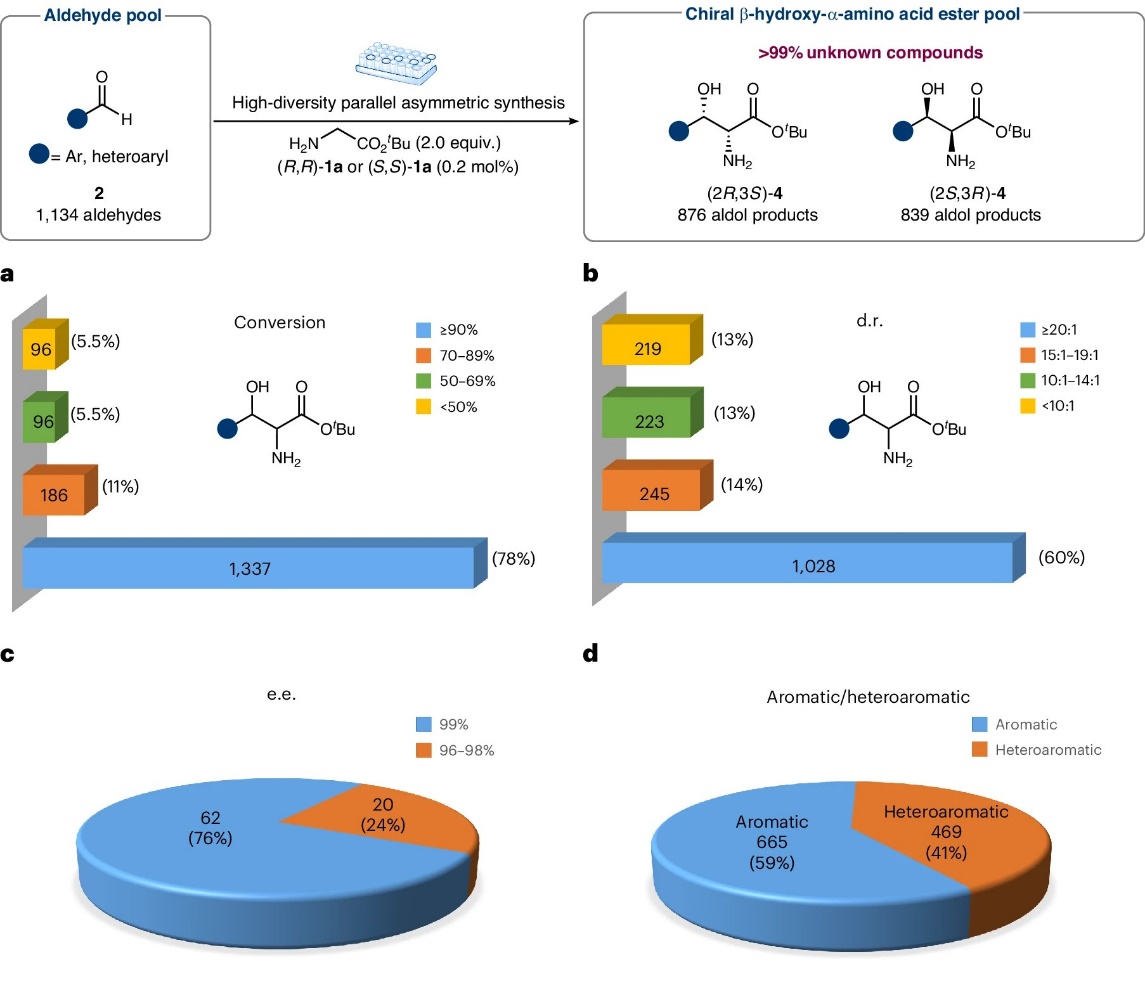
图4. 高多样性平行不对称合成
综上所述,赵宝国教授和肖晓教授团队以0.01-1 mol%手性吡哆醛为催化剂,实现了甘氨酸酯的仿生aldol反应,为手性β-羟基-α-氨基酸提供了高效的通用合成方法,并能快速构建结构多样的高活性分子库,对新药研发和药物高效合成都有重要意义。该仿生反应通过简单分子的一键链接实现了重要功能分子的高效构建,具有极高的效率、极广的底物适应性和多维选择性的精准控制,这是一个适应药物化学、AI/高通量合成等前沿领域发展需求的绿色反应新范例
上述研究工作得到了国家自然科学基金委、上海市科委、上海师范大学、上海市仿生催化前沿科学研究基地和上海绿色能源化工工程技术研究中心等资金支持。
文章信息
Asymmetric biomimetic aldol reaction of glycinate enables highly efficient synthesis of chiral β-hydroxy-α-amino acid derivatives.
Hanyu Liang, Peng Ren, Lei Wang, Dongchen Cai, Sheng Gong, Siqi Liu, Xiao Xiao *, Kuiling Ding2& Baoguo Zhao *
Nat. Catal. 2025, https://doi.org/10.1038/s41929-025-01364-z
(供稿、图片:化学与材料科学学院)












 徐汇校区:上海市徐汇区桂林路100号
徐汇校区:上海市徐汇区桂林路100号